
Департамент питания и здравоохранения Лозанна, Швейцария
Список сокращений
ASR: Cкорость абсолютного синтеза ( Absolute Synthesis Rate)
ВЗК: Воспалительные заболевания кишечника
FSR: Скорость фракционного синтеза (Fractional Synthesis Rate)
MUC2: муцин-2 ген
Muc2: муцин-2 протеин
Требования к количественному и качественному аминокислотному составу определены для здоровых животных. В патологических ситуациях, включая воспаление кишечника, защита организма связана с анаболическими реакциями, вовлекающими внутренние органы и особенно кишечник. Процессы защиты и восстановления кишечника резко увеличивают скорость синтеза белков, участвующих в барьерной функции кишечника, таких как муцины. Увеличивается потребность в специфических аминокислотах, в частности тех которые содержатся в муцинах. Питание для здоровых животных в этой ситуации не подходит. Увеличение содержания треонина, серина, пролина и цистеина в питании необходимо для того, чтобы повысить синтез муцина и усилить неспецифическую кишечную барьерную функцию.
Желудочно-кишечный тракт является одним из наиболее активных в метаболическом отношении органов организма, что отражает его многочисленные важнейшие биологические функции. В то время как желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, на его долю приходится более 20% оборота белка всего тела. Это происходит главным образом из-за высокой скорости синтеза белка и непрерывной высокой секреторной активности. Таким образом повышается необходимость в определенных аминокислотах, необходимых для синтеза белка. Такое высокое требование было приписано поддержке неспецифического кишечного барьера, в частности синтеза кишечных муцинов. Воспаление способствует повышению синтеза белка в кишечнике и, следовательно, расхода определенных аминокислот. В этом контексте для поддержания или восстановления целостности и функций кишечного барьера требуется адекватный контроль питания.
Защита кишечника обеспечивается как кишечной иммунной системой, так и физическим, неиммунным кишечным барьером. Кишечный барьер обеспечивает защиту от внешней среды (кишечных патогенов, вредных агентов и др.) пока происходит адекватная абсорбция питательных веществ для снабжения ими всего организма. Нормальная функция барьера базируется на близком взаимодействии нескольких компонентов. Ключевыми компонентами являются: .
Сложные регуляторные механизмы обеспечивают тонкое равновесие между различными компонентами неиммунного кишечного барьера. Оптимальная диетическая поддержка имеет решающее значение для обеспечения кишечного гомеостаза, способствуя поддержанию здоровья всего организма и предотвращая заболевания, связанные с желудочно-кишечным трактом.
Желудочно-кишечный эпителий покрыт вязкоупругим гелеобразным слоем слизи, состоящим из: .
Гелеобразная слизь представляет собой первую линию врожденной защиты хозяина. Функцией белка муцина является защита эпителиальных поверхностей от механических нагрузок и воздействия пищеварительных соков, микроорганизмов и токсинов. Ее защитный эффект напрямую связан с ее толщиной и составом. Уникальная защитная способность гелеобразной слизи обусловлена, в частности, высоким содержанием гликопротеинов, которые непрерывно синтезируются и секретируются бокаловидными клетками кишечника и эпителиальными клетками слизистой оболочки по всему желудочно-кишечному тракту.
Толщина слоя слизи, ее состав и защитное действие изменяются в желудочно-кишечном тракте по всей его длине в результате дифференциальной выработки различных отдельных муцинов и динамического баланса между анаболическими (экспрессия, синтез и секреция из бокаловидных клеток) и катаболическими (физическая и протеолитическая деградация) процессами. В желудке и толстой кишке определяется самый толстый слой слизи, необходимый для того, чтобы обеспечить хорошую защиту от кислого субстрата (желудок) и микробиоты (толстая кишка). В тонком кишечнике – напротив, он самый тонкий, вероятно, чтобы не препятствовать усвоению питательных веществ.
Внутренний, прочно прикрепленный слой слизи, состоящий из мембраносвязанных муцинов, прилипает к апикальной стороне эпителиальных клеток и способствует образованию гликокаликса, полисахаридного матрикса, покрывающего поверхность эпителиальных клеток кишечника.
Растворимый, слабо прикрепленный наружный слой слизи, состоящий из секретируемых гелеобразующих муцинов, покрывает внутренний слой слизи. Этот растворимый слой способствует созданию и поддержанию баланса комменсальной микробиоты, которая противостоит потенциально патогенным бактериям.
На сегодняшний день идентифицирован 21 ген муцина, из которых 15 экспрессируются в желудочно-кишечном тракте человека. Муцины кишечника обладают некоторыми особенностями строения. Это обычно крупные полипептиды (10% -20% от общей массы муцина), которые очень сильно гликозилированы (до 80% -90% от массы муцина). Олигосахаридные боковые цепи в основном состоят из N-ацетилгалактозамина, N-ацетилглюкозамина, галактозы и фукозы, связанных преимущественно с сериновыми и треониновыми остатками муцинового полипептидного ядра через O-гликозидные связи. Посттрансляционные модификации, включая сиалирование и сульфатирование, завершают макромолекулу.
Размер полипептида муцина обычно колеблется от 200 КДА до 900 КДА, за исключением слюнной формы MUC7 (39 КДА). По сравнению с другими белками млекопитающих муцины особенно обогащены аминокислотами треонином, серином и пролином, которые составляют до 28%, 14% и 13% соответственно от общего аминокислотного состава муцинов. Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (proline, threonine, serine), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
Среди 15 муцинов, экспрессируемых в желудочно-кишечном тракте человека, MUC2, MUC5AC, MUC5B, MUC6, MUC7 и MUC19 секретируются в основном специализированными бокаловидными клетками. В тонком и толстом кишечнике MUC2 является преобладающим гелеобразующим муцином. Его важная роль в защите эпителия толстой кишки от колита была четко продемонстрирована на модели мышей с дефицитом Muc2. MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16 и MUC17 являются мембраносвязанными муцинами, экспрессируемыми клетками эпителия слизистой оболочки желудочно-кишечного тракта человека.
В тонком и толстом кишечнике MUC3, MUC4, MUC13 и MUC17 являются преобладающими мембраносвязанными формами. Они простираются над поверхностью клетки и образуют гликокаликс. Предполагается, что мембранные муцины занимают особое место в антиадгезивных и сигнальных механизмах, восстановлении клеток кишечника и защите эпителиальных клеток от инфекции.
Для обеспечения адекватной экспрессии и секреции муцина, необходимого для оптимальной защиты кишечника применяются сложные регуляторные механизмы. Было выявлено, что эти механизмы включают нейронные, гормональные и паракринные пути. Статус питания, который позволяет обеспечить достаточное количество аминокислот, необходимых для синтеза муцина и микробиоты также является ключевым регулятором защиты кишечника.
Многие кишечные заболевания, предполагающие хроническое воспаление, такие как воспалительные заболевания кишечника (ВЗК), связаны с дисфункцией кишечного барьера. Два основных типа ВЗК - язвенный колит и болезнь Крона, сопровождаются повышением проницаемости тонкой и толстой кишки. Среди изменений, наблюдаемых на уровне кишечного барьера, были отмечены изменение состава микробиоты кишечника и качественное и количественное ухудшение слизистого слоя и продукции муцина. В частности, синтез зрелой, гликозилированной формы MUC2, первичного муцина, секретируемого в толстой кишке, снижается у больных язвенным колитом, что ухудшает слизистый барьер.
Сообщалось также об аномальном выделении секретируемых в ЖКТ муцинов в подвздошной и ободочной кишках, что может отражать адаптивный ответ на усиление защитной реакции. Было отмечено, что ухудшение защиты эпителия сопровождалось снижением выделения мембраносвязанных муцинов MUC3, MUC4 и MUC17. Однако, и это интересно, экспрессия MUC13, выделяемого для ингибирования индуцированного токсинами апоптоза клеток эпителия толстой кишки, как было показано, увеличивается в биоптатах воспаленной слизистой оболочки толстой кишки, отражая защитный механизм, который, тем не менее, остается недостаточным для поддержания или восстановления функции кишечного барьера.
Метаболические нарушения, связанные с острыми системными воспалительными реакциями, наблюдаемыми, например, при сепсисе, также влияют на барьерную функцию кишечника. Острое воспаление стимулирует синтез белков острой фазы в печени и слизистых оболочках, а также муцинов в кишечнике. Эти анаболические реакции являются важными адаптациями, направленными на обеспечение защиты организма от первичных и вторичных патологических воздействий. Таким образом, ключевым фактором инициации и поддержания подобных защитных сил организма является способность хозяина поддерживать стимуляцию синтеза белка. В этом контексте наблюдается сильное увеличение потребности в аминокислотах, особенно, присутствующих в муцинах в большом количестве. В болезненном состоянии потребление пищи часто снижается, и запас пищевых аминокислот слишком низок, чтобы удовлетворить метаболический спрос. При этом организм использует аминокислоты, полученные путем катаболизма мышц.
Желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, в то время как на его долю приходится более 20% всего оборота белка в организме. Это связано с его высокой пролиферативной и секреторной активностью, которые поддерживают неиммунную барьерную функцию кишечника, в частности быстрое обновление эпителиальных клеток и непрерывный синтез кишечных муцинов. Аминокислотный состав синтезируемых и секретируемых белков в значительной степени влияет на аминокислотные потребности кишечника, которые должны быть обеспечены при помощи питания и эндогенным синтезом (при недостатке аминокислот).
Треонин является незаменимой аминокислотой, что означает, что он не может быть синтезирован организмом и поэтому должен поступать с пищей. В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника. Действительно, по сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Поскольку основной белок кишечных муцинов содержит большое количество треонина (до 30% от их аминокислотного состава), их непрерывный синтез объясняет высокую скорость утилизации треонина желудочно-кишечным трактом. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое окисление неиспользованного треонина, которое связано с его избыточным поступлением, происходящим в отсутствие синтеза Muc2.
И наоборот, когда поступление треонина с пищей ниже потребности, треонин может стать лимитирующей аминокислотой для синтеза кишечных муцинов, как показано на крысах, свиньях и поросятах. Действительно, было определено, что скорость фракционного синтеза муцина, определяемая как % муцинов, синтезируемых в сутки, уменьшается наполовину в верхней части тонкого кишечника крыс, получавших диету, покрывающую только 30% их потребности в треонине (Рис. 1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на общий синтез белка слизистой оболочки (Рис.1), причем эти остальные белки слизистой содержат примерно в семь раз меньше треонина, чем Muc2. Поскольку муцины особенно устойчивы к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом оптимальный синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
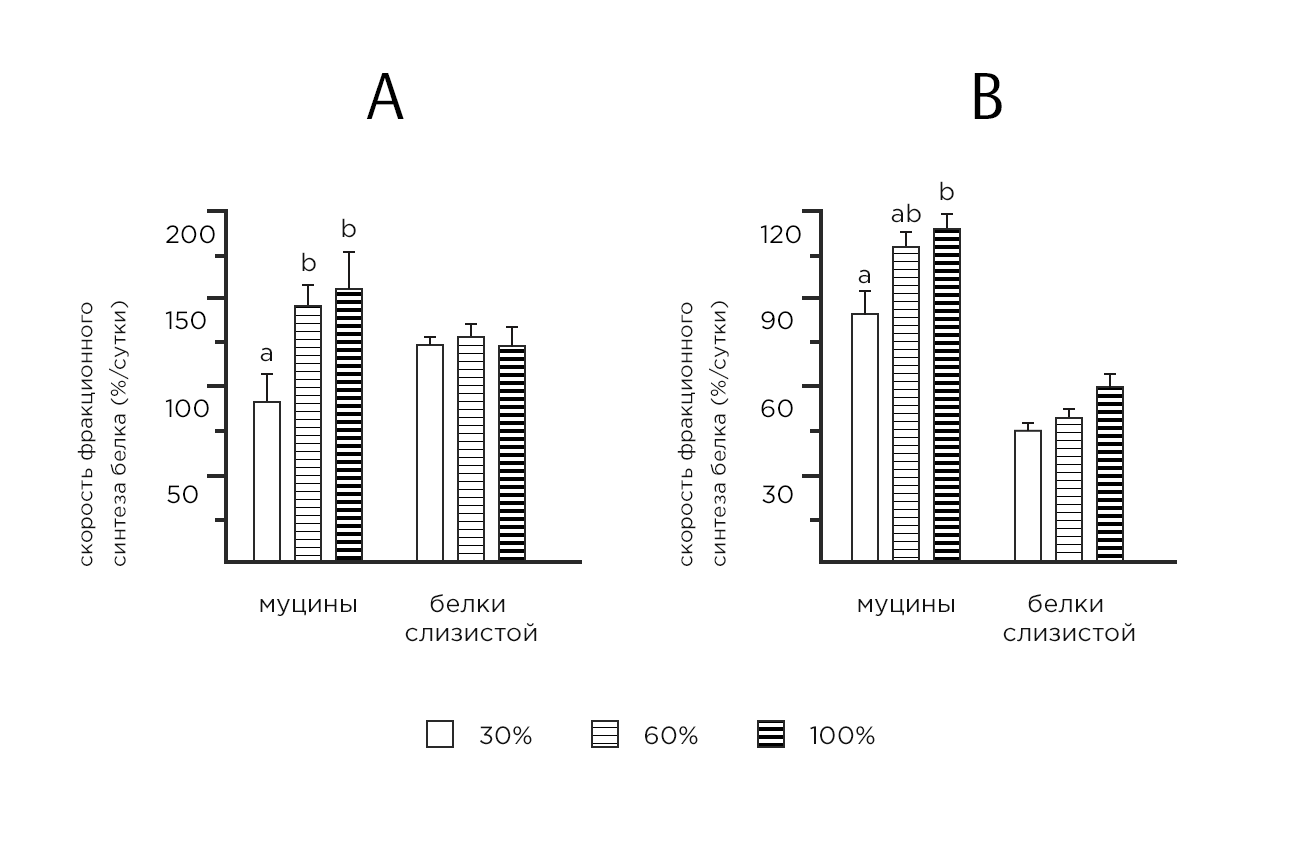
Схема 1. Скорость фракционного синтеза (FSR), выраженный в %/сутки, муцинов и общих белков слизистой оболочки в верхнем тонком кишечнике (а) и толстом кишке (Б) крыс, получавших полусинтетические диеты, удовлетворяющие 30%, 60% или 100% их потребности в треонине для роста. Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс получали питание парно для усреднения потребления крысами из группы 30%. Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L-(1-13C) - валина. Значения-средние ± SEM, n=8. Для каждой составляющей кишечника (муцины или белки слизистой оболочки).
Как показано на моделях животных и людях, воспалительные ситуации, такие как наблюдаемые при ВЗК (хроническое воспаление) и сепсис (острое воспаление), связаны с общей повышенной анаболической реакцией, происходящей в основном в кишечнике и печени, соответственно. Этот анаболический ответ увеличивает использование аминокислот, в частности, присутствующих в больших количествах в кишечных и печеночных протеинах. Поэтому потребности в треонине и других аминокислотах, таких как серин и цистеин, сильно повышаются. Доступность первично лимитирующих (треонин) и вторично лимитирующих (серин, цистеин) аминокислот для синтеза кишечных муцинов, может оказаться слишком низка из-за недостаточного качества питания (недостаточный уровень этих аминокислот) и количества (плохой аппетит) потребления пищи. Например, через два дня после заражения было показано, что использование треонина для синтеза муцинов в кишечнике крыс на 70% больше, чем у крыс контрольной группы. В целом, суточное абсолютное потребление треонина для синтеза белков кишечника (стенки кишечника) и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для синтеза муцина.
Таким образом, при воспалительных состояниях необходима адекватная и хорошо сбалансированная нутритивная поддержка для стимуляции защитного ответа, механизмов регенерации и, следовательно, поддержания или восстановления эффективной барьерной функции кишечника. Определение "адекватного и хорошо сбалансированного питания" будет зависеть от метаболического состояния, связанного с болезнью, и определенно будет разниться с таковым для здорового состояния.
Как ранее наблюдалось в моделях животных с ВЗК, кишечная продукция муцина не усиливалась с помощью здорового, сбалансированного питания. Однако было показано, что увеличение содержания треонина, серина, пролина и цистеина в рационе крыс на модели колита эффективно способствует синтезу муцина толстой кишки в зависимости от дозы, не оказывая при этом влияния на общие белки слизистой оболочки (Рис.2).Более высокая доза аминокислот увеличивала присутствие Muc2-содержащих бокаловидных клеток в поверхностном эпителии изъязвленной области. Она также способствовала росту всех тестируемых популяций комменсальных бактерий, включая лактобацилл.
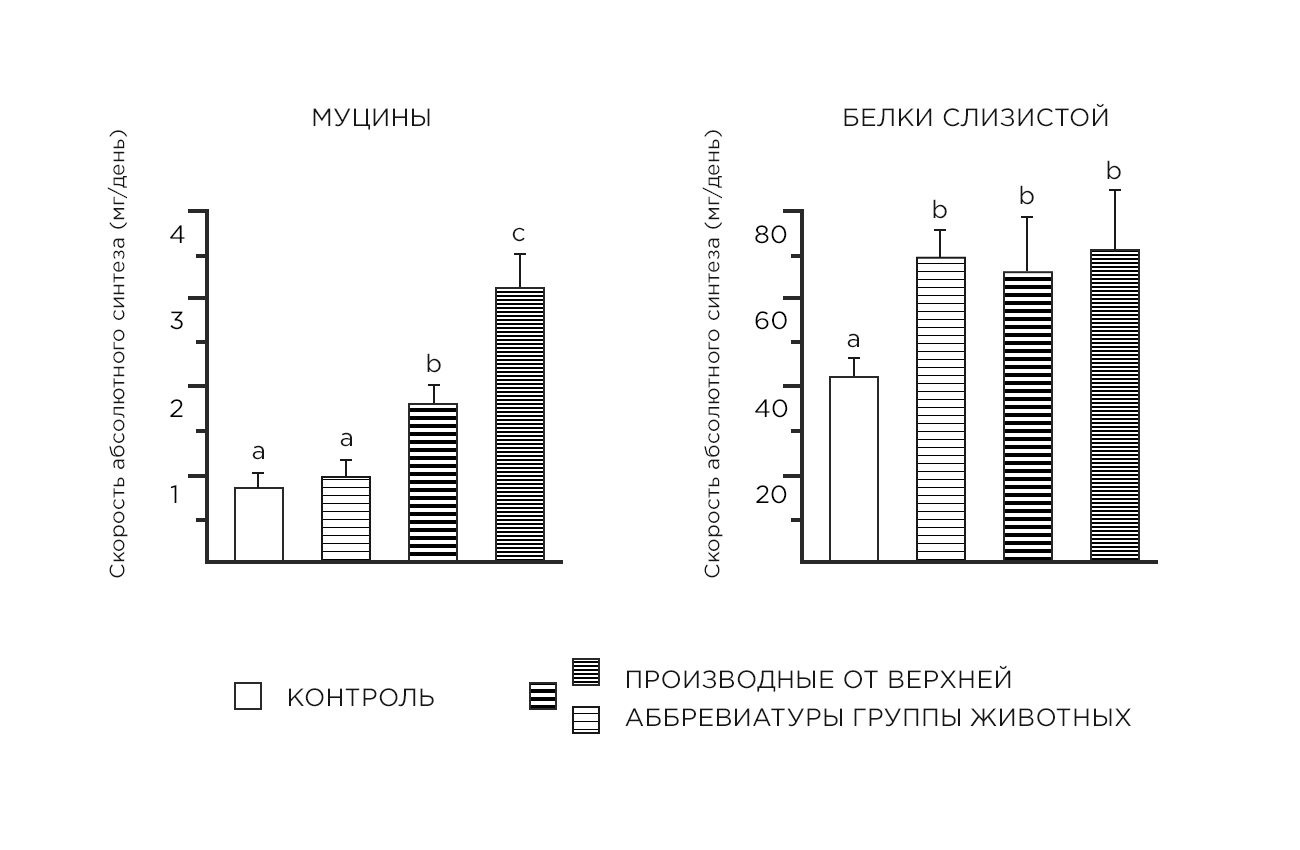
Схема 2. Скорость абсолютного синтеза (ASR), выраженные в мг/сут, муцинов и белков слизистой оболочки в толстой кишке крыс, получавших декстран сульфат натрия (DSS). Крыс кормили в течение 28 дней изонитрогенными (скорректированными с аланином) полусинтетическими порошковыми диетами, обеспечивающими следующие уровни состава по сравнению с потребностями крыс: DSSM1; двукратное увеличение треонина, пролина, серина и цистеина; DSSM2; четырехкратное увеличение треонина и пролина; и трехкратное увеличение серина и цистеина. Значения-средние ± SEM (n=8). Для каждой составляющей кишечника (муцины или белки слизистой оболочки) средства без общей буквы различаются, Р
Содержание аминокислот треонина, серина, пролина и цистеина относительно высоки в составе кишечных муцинов, что отчасти объясняет их высокое потребление кишечником. А значит адаптированная диетическая поддержка с точным регулированием количества этих четырех аминокислот, имеет решающее значение для поддержания эффективной барьерной функции кишечника. Патологические ситуации, включая воспаление кишечника, процессы защиты кишечника и восстановление тканей, еще больше увеличивают потребность организма в перечисленных выше аминокислотах. В таких ситуациях рекомендуется увеличить поступление с пищей треонина, серина, пролина и цистеина, чтобы стимулировать синтез муцина, способствовать росту и равновесию комменсальной микробиоты и, таким образом усилить неспецифическую неиммунную функцию кишечного барьера.
Статья на нашем канале Яндекс Дзен.
Автор перевода: Анатолий Черников – ветеринарный врач, специалист в области стоматологии, гастроэнтерологии, эндоскопии